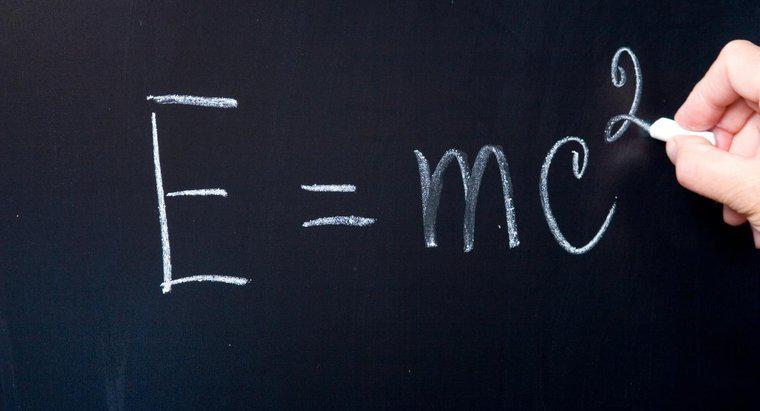"Najwyższy zajmowany poziom energii" oznacza poziom energii, w którym rezydują elektrony walencyjne. Elementy podążają za regułą oktetu, co oznacza, że chcą osiągnąć stabilny układ ośmiu elektronów na najwyższym zajętym stanowisku poziom energii. Niektóre atomy chcą oddać elektrony, a inne chcą uzyskać elektrony, aby stały się bardziej stabilne.
Elektrony walencyjne istnieją tylko w orbitalach s i p o najwyższym poziomie energii. Zasada Aufbau stwierdza, że elektrony muszą najpierw wypełnić najniższe poziomy energii, zanim przejdą do następnego poziomu energii. Każdy poziom energii ma określoną liczbę orbitali; tylko dwa elektrony obracające się w przeciwnych kierunkach mogą wypełnić każdą orbitę. Elektrony istnieją w różnych odległościach od jądra atomu. Te elektrony zajmujące orbitale bliżej jądra mają niższą energię niż te, które krążą dalej.
Najbardziej stabilne pierwiastki w układzie okresowym, gazy szlachetne, mają osiem elektronów na najwyższym, zajętym poziomie energii; gazy szlachetne nie tworzą łatwo związków z innymi pierwiastkami. Elektrony o najwyższym poziomie zajmowanej energii mają wiele wspólnego z reaktywnością pierwiastka. Elementy takie jak metale z kilkoma elektronami o najwyższym poziomie energii chcą przekazać je innym elementom. Elementy takie jak niemetale mają niemal pełny dopełniacz ośmiu elektronów w swoich najbardziej oddalonych poziomach energii, więc chcą uzyskać elektrony z elementów.