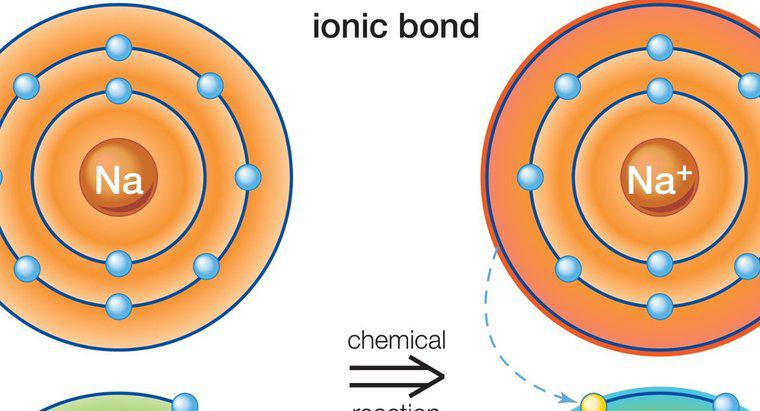
Związki jonowe powstają, gdy elektrony przenoszą się z jednego atomu do drugiego. Związki kowalencyjne powstają, gdy atomy dzielą się elektronami, co powoduje brak strat lub przyrostów elektronów w związku jonowym.
Kiedy łączą się dwa lub więcej różnych pierwiastków chemicznych, tworzą one związek. To, jak te atomy łączą się lub wiążą ze sobą, zależy od elementu i jego cech. Wiązanie, które trzyma razem atomy, określa rodzaj związku, który jest, i może być jonowe lub kowalencyjne.
Podstawy wiązania Atomy są klasyfikowane i charakteryzowane przez liczbę elektronów, które zawierają. Każdy element ma różną liczbę elektronów umieszczonych w orbitach krążących wokół jądra. Zewnętrzny orbital jest znany jako orbital wartościowości, a te elektrony są używane w procesie wiązania. Każdy atom dąży do posiadania pełnej zewnętrznej orbity elektronów, aby być stabilnym. Dla większości atomów ten zewnętrzny orbital zawiera osiem elektronów. Zasada oktetu odnosi się do wymagania elektronów do zdobywania, tracenia lub współdzielenia elektronów w celu wypełnienia zewnętrznego orbity. Kiedy atomy zyskują lub przekazują elektrony do innego pierwiastka, tworzą związki jonowe. Gdy atomy dzielą elektrony z innym pierwiastkiem, tworzą związki kowalencyjne.
Związki jonowe
Związki jonowe tworzą się między metalami a niemetaliami. Metale zazwyczaj mają niewiele elektronów walencyjnych w zewnętrznym orbicie, podczas gdy niemetale mają wiele. Metal działa jak donor i przenosi elektrony walencyjne do niemetalu, spełniając w ten sposób zasadę oktetu niezbędną do utworzenia stabilnego atomu. Daje to dodatnio naładowany atom metalu i ujemnie naładowany atom niemetalu, znany jako jony. Z powodu przeciwnych ładunków dwa jony są przyciągane do siebie i pozostają blisko siebie, tworząc w ten sposób związek jonowy. W tym procesie można przenosić więcej niż jeden elektron. Ponieważ naładowane atomy swobodnie się poruszają, przyciąga je do innych atomów o przeciwnych ładunkach, a nie tylko do pojedynczego atomu, który oddały lub otrzymały elektrony.
Charakterystyka związków jonowych polega na tym, że są one krystalicznymi ciałami stałymi o wysokich temperaturach topnienia i wrzenia. Podczas topienia przewodzą prąd elektryczny i są rozpuszczalne w wodzie, ale nie w cieczach niepolarnych. Jednym z najczęstszych związków jonowych jest chlorek sodu (NaCl), znany również jako sól kuchenna.
Związki kowalencyjne
W przeciwieństwie do tego, kowalencyjne związki zwykle występują między niemetale lub dwoma atomami tego samego lub podobnego pierwiastka. Atomy o podobnych elektroujemnościach, które można określić na podstawie układu okresowego, mają tendencję do przyciągania się i tworzenia wiązań kowalencyjnych. Zamiast całkowicie przenosić elektrony walencyjne, atomy dzielą zewnętrzne elektrony, aby spełnić zasadę oktetu. Współdzielone elektrony mogą poruszać się w przód i w tył między związanymi atomami. Żaden z atomów nie zyskuje ani nie traci elektronu w tego rodzaju wiązaniach, więc nie tworzą się jony. Z tego powodu atomy w związku nie są przyciągane do innych atomów znajdujących się w pobliżu, jak te występujące w związkach jonowych.
Związki kowalencyjne mogą być ciałami stałymi, cieczami lub gazami. Mają tendencję do bycia słabymi przewodnikami elektrycznymi i mają niskie temperatury topnienia i wrzenia. Mają tendencję do rozpuszczania się w cieczach niepolarnych, ale nie w wodzie. Niektóre typowe przykłady kowalencyjnych związków to metan (CH4) i dwutlenek węgla (CO2).