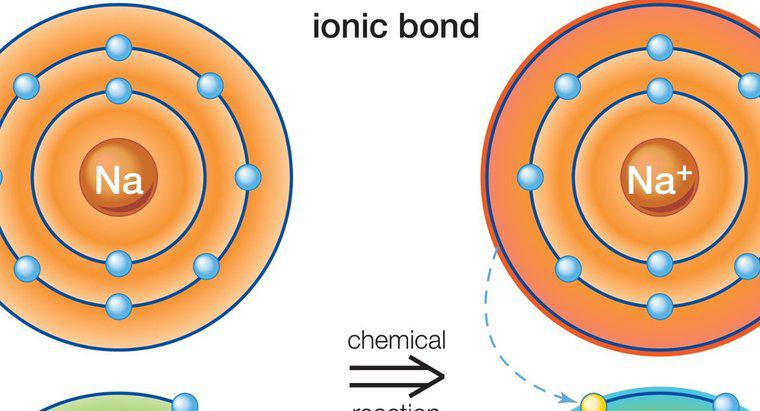
Wiązanie jonowe obejmuje metal i niemetal. Dzieje się tak dlatego, że wiązanie jonowe wiąże się z transferem elektronów walencyjnych. Powstałe wiązanie tworzy dwa przeciwnie naładowane jony.
Wiązanie jonowe występuje między metalami i niemetalami, ponieważ metale mają niewiele elektronów w zewnętrznym pierścieniu. To sprawia, że metale są bardziej gotowe do utraty elektronów, ponieważ doprowadzi to do uzyskania stabilnej konfiguracji jonów. Niektóre niemetale mają blisko osiem elektronów i wymagają więcej elektronów, aby uzyskać konfigurację gazu szlachetnego.
Więcej niż jeden elektron może być dzielony między elementami. Gdy jeden element zyskuje, a drugi traci, prowadzi to do tego, że jeden element staje się dodatnio naładowany, a drugi ujemnie naładowany. To, czy dany element stanie się dodatni czy ujemny, zależy od tego, czy stracili, czy uzyskali elektrony. Strata będzie prowadzić do ładunku dodatniego, podczas gdy dodatkowy elektron prowadzi do ładunku ujemnego. Ładunek netto w związku musi wynosić zero. Jak zawsze są to elektrony oddające metal, metalowy element jest dodatni, a niemetalowy jest ujemny.
Przykładem wiązania jonowego jest związek chlorek sodu, który jest powszechnie znany jako sól kuchenna. Sód zawiera jeden elektron w swoim najbardziej zewnętrznym pierścieniu, podczas gdy atom chloru zawiera siedem. Sód przenosi swój elektron do chloru i staje się dodatnio naładowany, podczas gdy chlor staje się naładowany ujemnie. Ładunek netto związku wynosi zero, ponieważ oba pierwiastki są związane.