Przykłady rozpuszczalników obejmują wodę, aceton, terpentynę i etanol, a przykłady substancji rozpuszczonych obejmują sól, cukier, jod i siarczan miedzi. Rozpuszczalnik musi mieć taką samą polarność jak substancja rozpuszczona. Ważnym zwrotem w chemii jest "jak rozpuszczanie się".
"Podobnie jak rozpuszcza się" odnosi się do faktu, że polarne substancje rozpuszczone rozpuszczą się w polarnych rozpuszczalnikach, a niepolarne substancje rozpuszczone będą rozpuszczały się tylko w niepolarnych rozpuszczalnikach. Roztwory polarne nie mogą rozpuszczać się w niepolarnych rozpuszczalnikach. Woda jest polarnym rozpuszczalnikiem, sól i cukier są zarówno polarnymi substancjami rozpuszczonymi. Aby rozpuścić jod, który nie jest polarny, potrzebny byłby rozpuszczalnik taki jak octan etylu, który nie rozpuściłby się w wodzie.
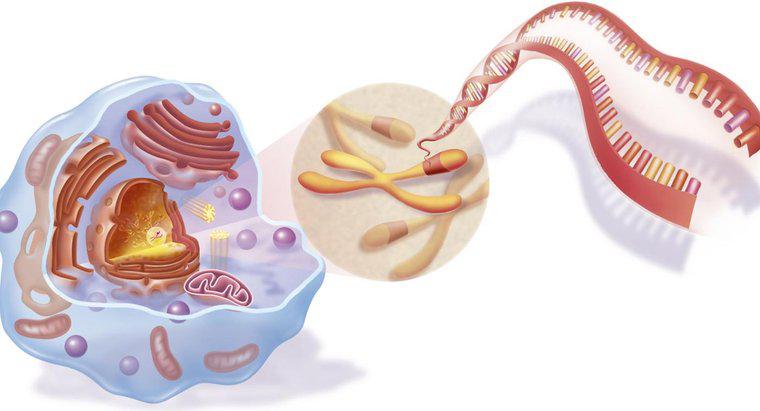
Polarność każdego rozpuszczalnika lub substancji rozpuszczonej zależy od kowalencyjnych wiązań między atomami. Kiedy dwa niemetalowe atomy łączą się, dwa elektrony są dzielone między każdym z nich. W wiązaniach kowalencyjnych elektrony dzielone przez każdy z atomów są przyciągane do jądra obu atomów. Dwie formy wiązania kowalencyjnego są polarne i niepolarne. Wiązania niepolarne tworzą się z równym podziałem elektronów między atomami. Wiązania polarne powstają, gdy podział elektronów jest nierównomierny. Wiązania jonowe mają miejsce, gdy następuje całkowite przeniesienie elektronów między atomami. Te jonowe substancje rozpuszczone mogą rozpuszczać się zarówno w polarnych rozpuszczalnikach, jak iw rozpuszczalnikach jonowych.