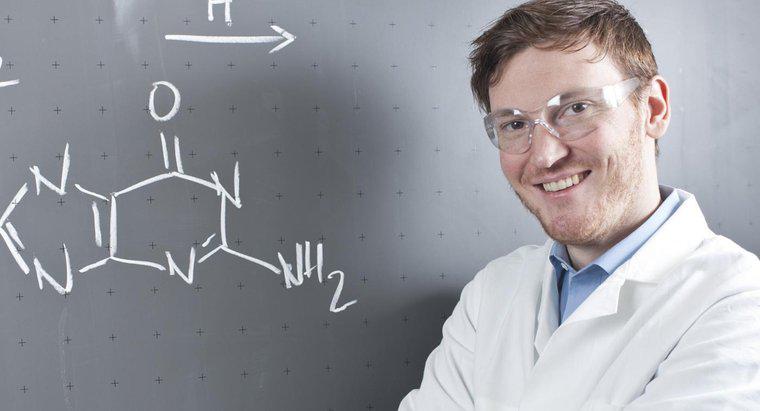
Strzałka wskazująca w obu kierunkach w równaniu chemicznym pokazuje, że reakcja jest odwracalna i może przebiegać w obu kierunkach. Oznacza to, że reagenty po lewej stronie są również produktami reakcji te po prawej i na odwrót.
Niepoprawne jest zapisywanie odwracalnej reakcji jako dwóch oddzielnych równań chemicznych (po jednym dla każdego kierunku), ponieważ produkty zawsze reagują i wracają z powrotem do oryginalnych reagentów. Ponieważ obie reakcje zachodzą jednocześnie, układ chemiczny znajduje się w stanie strumienia dopóki równowaga nie zostanie osiągnięta. Oznacza to, że istnieje punkt, w którym stężenie każdego reagenta pozostaje stałe i nie wykazuje żadnej zmiany netto w czasie. Nie oznacza to jednak, że każdy reagent występuje w równych proporcjach.
Szybkość reakcji i współczynniki reakcji każdego reagenta określają jego ilość i szybkość. Ponieważ niektóre reakcje są szybsze i wymagają większych ilości jednego reagenta niż inne, nie występują one w równych ilościach, gdy układ osiąga równowagę. W układach dynamicznej równowagi szybkości reakcji dla obu stron równania są dokładnie takie same, więc stężenia reagentów i produktów pozostają stałe, nawet jeśli obie reakcje nadal trwają w nieskończoność.