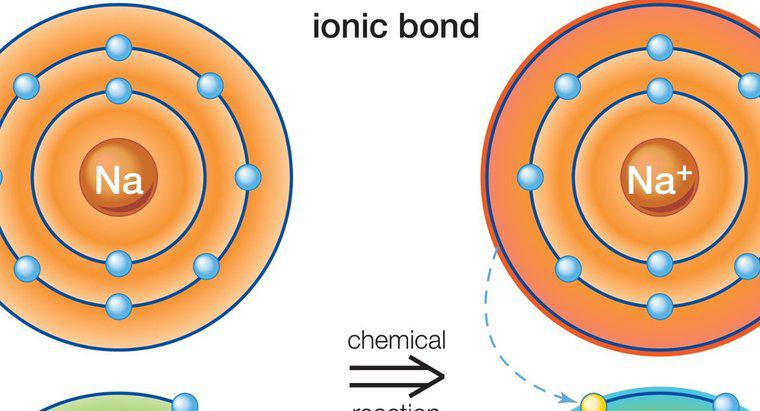
Większe atomy ze złożonymi orbitaliami elektronowymi, takie jak te znajdujące się w metalach przejściowych, są w stanie przekroczyć zasadę oktetu we właściwych warunkach. W szczególności występują one, gdy cięższe pierwiastki są związane z małe, wysoce elektroujemne pierwiastki, takie jak fluor, chlor lub tlen. Jednym z przykładów jest pentachlorek fosforu, pojedynczy atom fosforu związany z pięcioma atomami chloru, który ma 10 wspólnych elektronów w swojej zewnętrznej powłoce walencyjnej.
Gdy element ma wystarczająco dużą liczbę atomową, dostępny jest nowy typ orbity elektronowej o pojemności do 10 elektronów, umożliwiający do pięciu pojedynczych wiązań. Tak dzieje się w przypadku pentachlorku fosforu. Jednakże, aby wykorzystać tę orbitę, reakcja tworzenia związku, który wykorzystuje tę orbitę, musi być bardzo korzystna energetycznie. Dlatego, aby działało, potrzebne są elementy o bardzo dużej zdolności przyciągania i wiązania elektronów, zwane również elektroujemnością. Tlen ma wysoką elektroujemność, ale jest mało prawdopodobne, aby wytworzył związek z pięcioma atomami związanymi, takimi jak chlor, ponieważ do jego zewnętrznej powłoki walencyjnej potrzeba dwóch elektronów. Fluor i chlor wymagają tylko jednego, więc taka konfiguracja jest bardziej prawdopodobna.