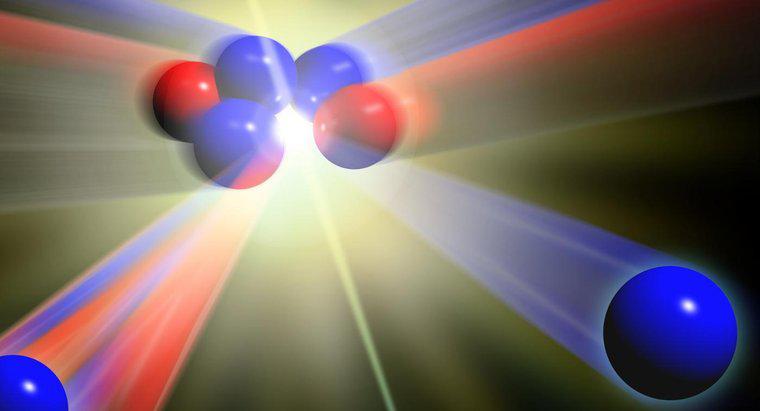
Atomy tego samego elementu, które mają różne masy, nazywane są izotopami. Różne masy powstają, gdy występuje różna liczba neutronów. Wszystkie atomy danego elementu mają taką samą liczbę protonów.
Aby zidentyfikować różne izotopy elementu, zapisuje się symbol elementu, a następnie liczbę neutronów. Na przykład dwa powszechne izotopy uranu są zapisywane jako U-236 i U-238.
Atom zazwyczaj ma taką samą liczbę neutronów i elektronów co liczba protonów. Gdy atom ma inną liczbę elektronów, ładunek elektryczny atomu staje się albo dodatni, jeśli mniej elektronów jest obecnych, albo ujemnych, jeśli obecne są dodatkowe elektrony. Atomy z ładunkiem dodatnim lub ujemnym nazywane są jonami. Kiedy atom ma różną liczbę neutronów, ponieważ neutrony nie mają ładunku elektrycznego, ładunek elektryczny atomu nie ulega zmianie. Izotopy mają jednak inną masę atomową.
Na układzie okresowym podano masę atomową lub masę atomową dla każdego elementu. Liczba nie jest liczbą całkowitą, ponieważ odzwierciedla naturalną obfitość izotopów pierwiastka. Na przykład masa atomowa wodoru wynosi 4,003. W obliczeniach chemicznych masę atomową stosuje się przy założeniu, że próbka elementu zawiera naturalny zakres izotopów dla elementu.