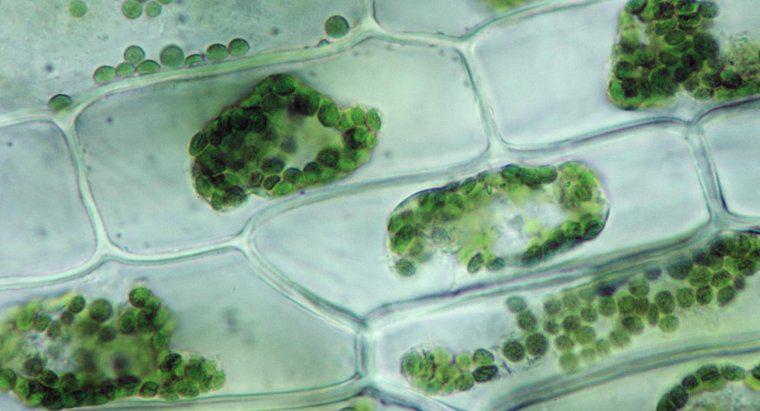
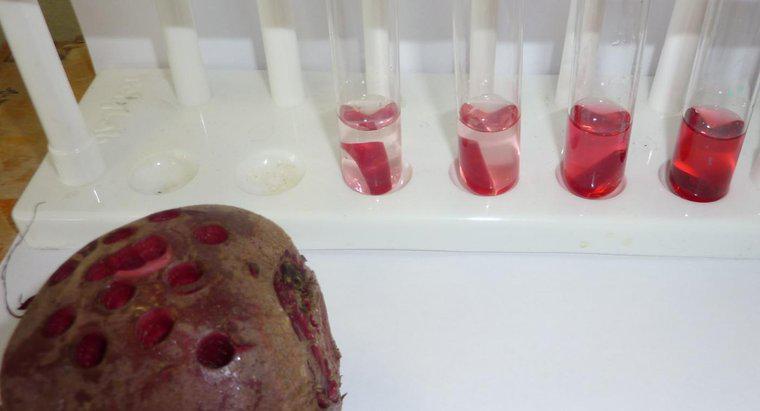
Osmoza jest szczególnym rodzajem dyfuzji, w której woda przecina półprzepuszczalną membranę z obszarem o większym stężeniu substancji rozpuszczonej, podczas gdy standardowa dyfuzja często pozwala na swobodny ruch obu substancji rozpuszczonych i rozpuszczalnika w kierunku równowagi. Dyfuzja w ogólności jest ruchem netto cząsteczek w roztworze z obszarów o wyższym stężeniu do obszarów o niższym stężeniu. Ciśnienie osmotyczne jest potencjalnie bardzo silne, a ciśnienie osmotyczne jest jedyną siłą niezbędną do przeniesienia wody z korzeni na wierzchołki najwyższych drzew na świecie.
Kiedy woda rozpuszcza inną substancję, dzieje się tak dlatego, że cząsteczki wody polarnej i substancja rozpuszczalna przyciągają się nawzajem. Każdy atom, jon lub cząsteczka substancji rozpuszczonej ma ładunek w co najmniej jednym regionie, który przyciąga jedną lub drugą stronę cząsteczki wody. Jako takie, jak najwięcej cząsteczek wody gromadzi się wokół każdej cząstki rozpuszczalnika. W ciekłej wodzie wszystkie cząsteczki znajdują się w stałym, losowym ruchu wokół siebie. Jednak ze względu na przyciąganie, cząsteczki wody są nieco bardziej skłonne do poruszania się w kierunku cząstek substancji rozpuszczonej niż są od nich oddalone, a cząstki rozpuszczone są bardziej skłonne do poruszania się w kierunku cząsteczek wody niż inne cząstki rozpuszczalnika. Ten ruch netto prowadzi stopniowo do równomiernego rozkładu substancji rozpuszczonej. W osmozie tylko cząsteczki wody mogą się przemieszczać w celu wyrównania stężeń.