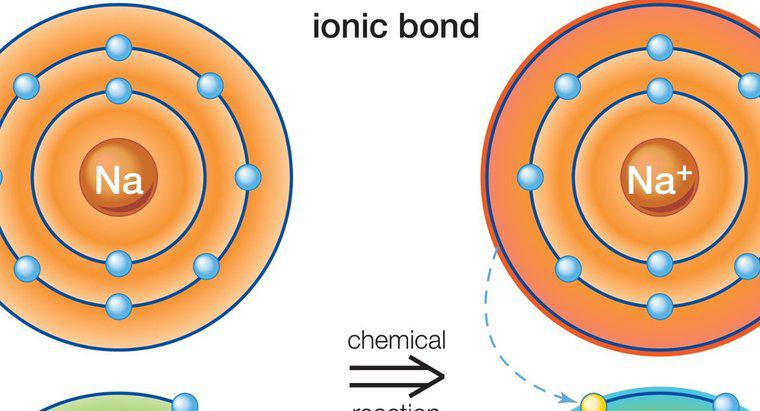
Związki jonowe i molekularne różnią się przede wszystkim sposobem powstawania. Związki jonowe powstają w wyniku transferu elektronów, natomiast związki molekularne powstają w wyniku podziału elektronów.
Związki jonowe zawierają atomy i cząsteczki o przeciwnych ładunkach. Łączą się ze sobą w wyniku swoich przeciwnych zarzutów. Na przykład, ujemnie sparowane wiązania jonowe z dodatnim jonem. Atomy i cząsteczki z podobnymi ładunkami odpychają się nawzajem. Cząsteczki z ładunkiem dodatnim nazywane są kationami, a cząsteczki o ładunku ujemnym nazywane są anionami.
Związki jonowe
Związki jonowe powstają w wyniku atomy lub cząsteczek przyciągających więcej atomów lub cząsteczek o przeciwnym ładunku. Skład jest różny w zależności od rodzaju związku, ale wszystkie związki jonowe muszą mieć neutralny ładunek elektryczny. Oznacza to, że muszą mieć taki sam stosunek cząsteczek anionowych i kationowych.
Związki jonowe są zazwyczaj stałe. Mogą być zbudowane z pojedynczych atomów, zwanych monatomicznymi lub z wielu atomów, co czyni je związkami wieloatomowymi. Wiązanie jonowe, które tworzy cząsteczki jonowe, obejmuje przenoszenie elektronów z metali do niemetali. Metale mają tendencję do szybkiego tracenia dodatnich elektronów, ponieważ mają niewiele elektronów na swoim zewnętrznym poziomie energii. Niemetale mają więcej ujemnych elektronów w swoim zewnętrznym poziomie energii. W rezultacie poszukują jonów dodatnich i naturalnie wiążą się z molekułami metalicznymi. Większość związków wieloatomowych jest anionowych, z wyjątkiem kationów amonowych. Związki jonowe różnią się od związków molekularnych tym, że mogą tworzyć z metali i niemetali, podczas gdy związki molekularne mogą tworzyć się tylko z niemetali. Typowymi typami związków jonowych są sól i cukier.
Związki molekularne
Związki molekularne, zwane także związkami kowalencyjnymi, współdzielą elektrony, tworząc wiązania kowalencyjne. Podczas gdy związki jonowe mogą składać się z atomów i cząsteczek metalicznych i niemetalicznych, wiązania kowalencyjne mogą tworzyć się jedynie z niemetalicznych atomów i cząsteczek. Kowalencyjny związek powstaje, gdy atomy w różnych elementach są łączone przez cząsteczki. To wiązanie umożliwia dzielenie się elektronów walencyjnych, co tworzy wspólną atrakcję, która utrzymuje razem atomy w cząsteczce.
Związki kowalencyjne różnią się znacznie wielkością. Niektóre są małe, z zaledwie kilkoma elementami, podczas gdy inne mogą mieć tysiące atomów. Ponieważ współdzielą elektrony zamiast je wymieniać, związki kowalencyjne mają znacznie inne właściwości niż związki jonowe. Związki kowalencyjne mają tendencję do łatwego spalania, podczas gdy związki jonowe nie. W przeciwieństwie do związków jonowych nie są one rozpuszczalne w wodzie. Inną różnicą między dwoma typami cząsteczek jest to, że związki kowalencyjne nie mogą przewodzić prądu, ale związki jonowe ogólnie mogą. W temperaturze pokojowej większość związków kowalencyjnych występuje w postaci ciekłej lub gazowej, zamiast występować jako ciała stałe. Wynika to z faktu, że ich poszczególne cząsteczki są łatwiej rozdzielane niż cząsteczki w krysztale, co daje im względnie niski punkt wrzenia. Proste związki cząsteczkowe mają taką samą strukturę nazwy. Są one znalezione w układzie okresowym, nazywając element, który pojawia się najdalej po lewej na stole, a następnie dodając "ide" do drugiego nazwanego elementu i używając prefiksów do identyfikacji liczby atomów w każdym elemencie. Białka i węglowodany to dwa przykłady związków molekularnych. Inne związki cząsteczkowe obejmują metan, tlenek azotu i chlorek sodu.