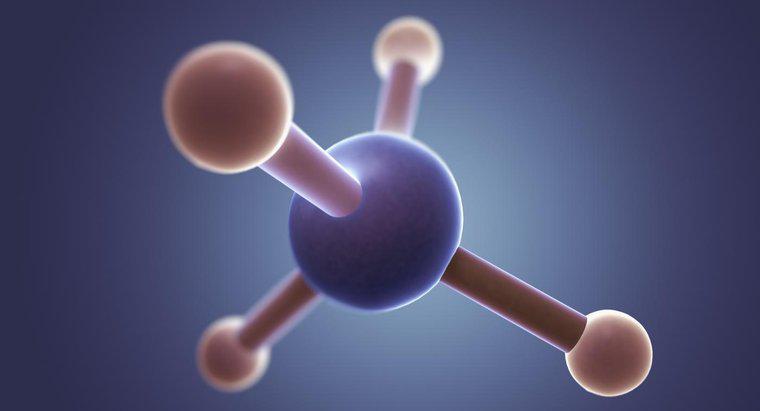
Chlorek metylu (CH3Cl) ma kształt czworościenny z kątem spięcia wynoszącym 109,5 stopnia. Dzieje się tak, ponieważ węgiel ma cztery elektrony walencyjne tworzące cztery wiązania, a w trójwymiarowej przestrzeni czworościenny kształt pozwala związanym elektronom znajdować się najdalej od siebie.
Kształty molekularne są przewidywane za pomocą teorii odpychania par elektronów powłoki walencyjnej (VSEPR). Według VSEPR, cząsteczki będą miały kształt geometryczny, który pozwoli ich ośrodkom ujemnego ładunku (elektrony wiązane i elektronów wolnych) być tak daleko od siebie, jak to możliwe, ze względu na wzajemne odpychanie ładunków ujemnych. Cząsteczki z dwoma ujemnymi centrami mają tendencję do występowania liniowości (kąt spięcia wynoszący 180 stopni w płaszczyźnie dwuwymiarowej). Cząsteczki z trzema ujemnymi centrami są trójkątne planarne (kąty więzów 120 stopni w dwuwymiarowej płaszczyźnie), a cząsteczki z czterema ujemnymi centrami są czworościenne (kąty więzów 108,5 stopnia w przestrzeni trójwymiarowej).
Chlorek metylowy ma centralny atom węgla otoczony czterema pojedynczymi wiązaniami (trzy do wodoru i jeden do chloru). Dlatego, zgodnie z VSEPR, cząsteczka będzie miała kształt czworościenny o kącie wiązania 108,5 stopnia, aby umożliwić maksymalne oddzielenie połączonych elektronów.