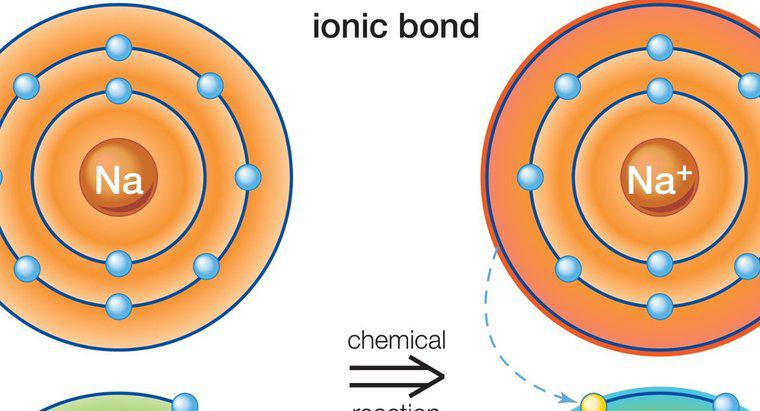
Rodzaj wiązania występujący w chlorku sodu nazywa się wiązaniem jonowym. Wiązanie jonowe jest atrakcją między dwoma atomami o przeciwnych ładunkach. W chlorku sodu sód ma ładunek dodatni, a chlor ma ładunek ujemny; dlatego przyciągają się nawzajem i tworzą więź.
Sód i chlor, jako neutralne atomy, nie są stabilne. Sód zawiera jeden walencyjny elektron, a chlor ma siedem. Reguła oktetowa stwierdza, że atomy chcą mieć zewnętrzną powłokę energetyczną podobną do tej z gazów szlachetnych, co oznacza, że potrzebują ośmiu elektronów walencyjnych. Te osiem elektronów na najbardziej zewnętrznym poziomie energii reprezentuje stabilność. Ani sód, ani chlor nie mają tej szlachetnej struktury gazowej, więc mają skłonność do utraty lub pozyskiwania elektronów, aby uzyskać bardziej stabilny stan. Sód traci swój pojedynczy walencyjny elektron do chloru i staje się kationem, dodatnio naładowanym atomem. Chlor zyskuje elektron i staje się anionem, atomem naładowanym ujemnie. Te dwa jony o przeciwnych ładunkach łączą się, tworząc wiązanie jonowe.