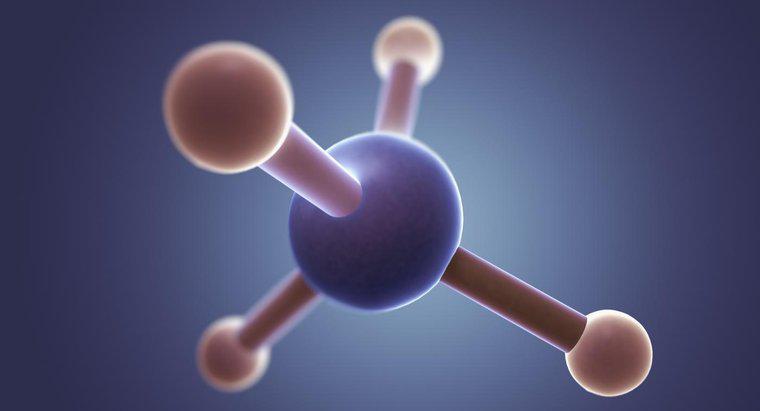
Struktura CS2 Lewisa składa się z pojedynczego atomu węgla z jednym atomem siarki po każdej stronie. Wiązania w strukturze Lewisa są albo podwójnym wiązaniem łączącym atom węgla z każdym atomem siarki, albo jednym atomem siarki łączącym się z potrójnym wiązaniem, a drugim z pojedynczym wiązaniem.
Struktury Lewisa dla cząsteczek są zazwyczaj zapisywane metodą prób i błędów, chyba że są już znane. Metoda określania struktury Lewisa wymaga uwzględnienia wszystkich elektronów walencyjnych, a wszystkie atomy w strukturze kończą się pełną powłoką elektronów walencyjnych.
Najpierw połącz wszystkie atomy za pomocą elektroujemności pierwiastków, aby określić, które atomy idą gdzie indziej. Zazwyczaj, jeśli masz atom węgla i kilka innych atomów, atom węgla będzie w centrum. W przypadku CS2 atom węgla jest mniej elektroujemny i tworzy centrum.
Następnie określ, ile jest obecnych elektronów. W CS2 atomy siarki dostarczają po 6 elektronów walencyjnych, a atom węgla tworzy cztery w sumie szesnaście. Potrzebne byłyby 24 elektrony, aby zapewnić wszystkie trzy atomy pełną powłoką walencyjną złożoną z 8 elektronów. Oznacza to, że cząsteczka CS2 musi mieć w sumie 8 wiązań łączących te trzy atomy.