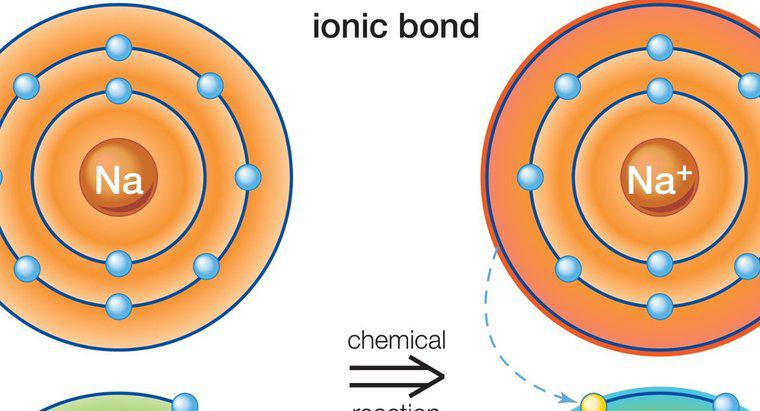
Ponieważ są one wynikiem przyciągania między ładunkami cząstkowymi, a nie pełnymi ładunkami, wiązania wodorowe są znacznie słabsze niż wiązania jonowe lub kowalencyjne. wiązania jonowe i kowalencyjne przyciągają atomy różnych substancji do siebie, tworząc cząsteczki związków, podczas gdy wiązania wodorowe są siłami, które mają tendencję do przyciągania do siebie cząsteczek. Przykładem wiązania wodorowego jest przyciąganie między poszczególnymi cząsteczkami wody, podczas gdy przyciąganie między atomami wodoru i tlenu w każdej cząsteczce wody oznacza wiązanie kowalencyjne.
Wiązanie wodorowe powstaje, gdy pozytywnie spolaryzowany atom wodoru w jednej cząsteczce zostaje przyciągnięty do wysoce elektroujemnego atomu w innej cząsteczce. W przykładzie cząsteczek wody ujemnie naładowany atom tlenu w jednej cząsteczce wody przyciąga dodatnio naładowany atom wodoru w innej cząsteczce wody. Atomy tlenu mają skłonność do kradzieży elektronów z dala od atomów wodoru w cząsteczkach. Kiedy to występuje w cząsteczce wody, utrata elektronów tworzy atom wodoru z częściowym ładunkiem dodatnim, który następnie przyciąga się do ujemnie naładowanego atomu tlenu w innej cząsteczce wody.
Wiązania wodorowe, które tworzą się między cząsteczkami wody, powodują ich sklejanie. Daje to wodzie wysoką temperaturę wrzenia, ponieważ do rozbijania międzycząsteczkowych wiązań wodorowych wymagany jest większy stopień energii cieplnej. Wiele substancji organicznych niezbędnych do podtrzymania życia, takich jak kwasy nukleinowe i białka, zawiera wiązania wodorowe. Chociaż wiązania te są słabsze niż wewnętrzne wiązania jonowe lub kowalencyjne istniejące między atomami w cząsteczkach, nagromadzona wytrzymałość wiązań wodorowych w żywych organizmach jest bardzo znacząca i odgrywa ważną rolę w utrzymaniu stabilności.