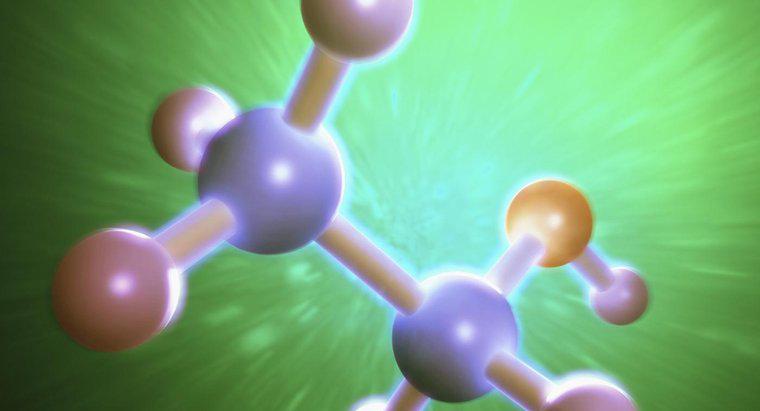
Istnieją trzy siły międzycząsteczkowe etanolu. Są to dyspersja w Londynie, dipol-dipol i wiązanie wodorowe. Wszystkie te trzy siły są różne ze względu na rodzaje wiązań, które tworzą i ich różne siły wiązania.
Pierwsza siła, dyspersja w Londynie, również jest najsłabsza. W dyspersji londyńskiej przyciąganie międzycząsteczkowe występuje między każdą cząsteczką. Jest to spowodowane wymianą elektronów między każdą cząsteczką, gdy są czasowo spolaryzowane. Ta tymczasowa polaryzacja występuje wtedy, gdy gęstość elektronów jest większa po jednej stronie cząsteczki niż druga.
Przyciąganie dipol-dipol występuje, ponieważ etanol jest cząsteczką polarną z zarówno dodatnio naładowanym, jak i jednym ujemnie naładowanym końcem. Ponieważ ładunki dodatnie i ujemne są przyciągane do siebie, przeciwne bieguny każdej cząsteczki tworzą wiązania. Ta atrakcyjność jest silniejsza niż dyspersja w Londynie, ale słabsza niż trzeci rodzaj przyciągania, wiązania wodorowe.
Ostateczną siłą jest wiązanie wodorowe. Wiązania wodorowe występują, gdy proton wiąże się z parą elektronów tlenowych w cząsteczce. Cząsteczka, która zapewnia to wiązanie jest znana jako donor, podczas gdy cząsteczka, która ma elektrony, do których przyciąga się wodór, znana jest jako akceptor. Etanol zawiera wiązanie O-H, co pozwala mu utworzyć wiązanie wodorowe.