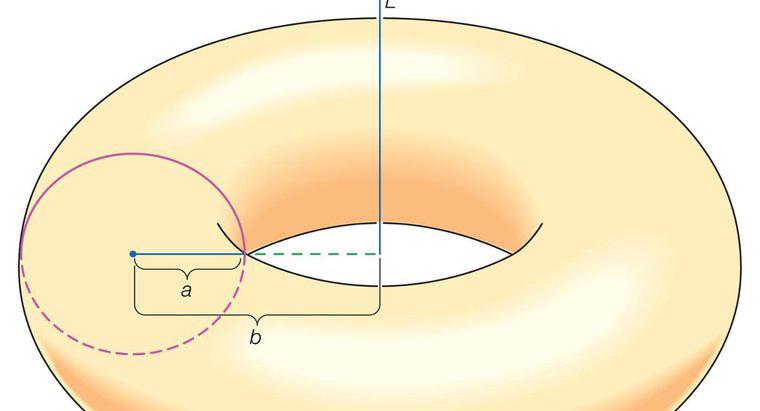
Gazy idealne są hipotetycznymi substancjami badanymi przez naukowców i studentów w celu uproszczenia sił międzycząsteczkowych. Idealne gazy są masami punktowymi, które nieustannie poruszają się w losowej, prostej linii. Zachowanie gazów doskonałych, czyli stosunek ciśnienia (P), temperatury (T) i objętości (V), jest podsumowany jako PV = nRT, gdzie "n" oznacza liczbę moli gazu. To równanie dla idealnych gazów zawsze będzie równe jeden.
Idealne gazy zawierają cząsteczki o pomijalnym rozmiarze, które posiadają średnią kinetyczną energię molową, która jest elastyczna tylko do temperatury. Gaz idealny jest uważany za "masę punktową", ponieważ jest tak mały, że jego masa jest praktycznie zerowa. Ciśnienie w stosunku do gazu idealnego jest wprost proporcjonalne do liczby cząsteczek i temperatury. Ciśnienie jest również pośrednio proporcjonalne do objętości w gazach doskonałych.
Gaz idealny ma dużą liczbę identycznych cząsteczek, a objętość zajmowana przez te cząsteczki jest nieistotna w porównaniu do objętości zajmowanej przez gaz. Cząsteczki są posłuszne prawom ruchu Newtona i podróżują tylko w chaotycznej lub przypadkowej naturze. Cząsteczki gazu doskonałego nie wchodzą w interakcje ze względu na niską gęstość gazu.
Cząsteczki gazów doskonałych odczuwają tylko siłę podczas kolizji. Zderzenia te są elastyczne, co oznacza, że nie są inicjowane przez siły przyciągające lub odpychające.