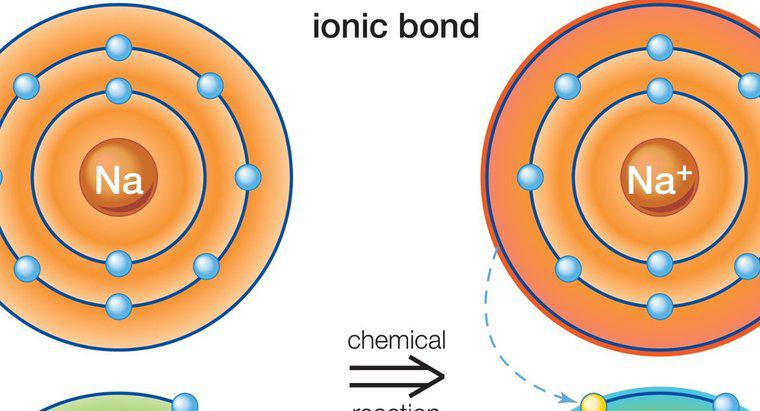
Wodne roztwory związków jonowych są dobrymi przewodnikami elektryczności, natomiast roztwory związków molekularnych nie są. Jest to prawdą, ponieważ poszczególne jony związków jonowych mogą całkowicie dysocjować w wodzie z cząsteczkami pozostającymi w całości. Związki jonowe i molekularne mają również wpływ na punkty wrzenia i topnienia wody.
Związki jonowe łatwiej rozpuszczają się w wodzie niż związki molekularne, chociaż istnieją wyjątki od tej reguły. Jako standard określa się rozpuszczalność związku, ponieważ jest wysoce polarny i może rozpuszczać więcej związków niż jakikolwiek inny rozpuszczalnik, nadając mu nazwę uniwersalnego rozpuszczalnika. Związki jonowe przewodzą elektryczność, gdy dysocjują, ponieważ ułatwiają przenoszenie elektronów. Różnica w ładunkach cząstek umożliwia swobodnym przeskokom elektronów z cząstek do cząstek. Molekuły dzielą się elektronami i mają ogólny neutralny ładunek, który nie pozwala na dużą przewodność.
Związki jonowe mają wysokie temperatury topnienia i wrzenia, podczas gdy związki cząsteczkowe mają względnie niskie temperatury topnienia i wrzenia. Te właściwości przenoszą się do wody, gdy rozpuszczają się w niej związki. Dysocjowane związki jonowe podwyższają temperaturę topnienia i obniżają temperaturę krzepnięcia wody. Związki molekularne mają na ogół odwrotny skutek, jeśli rozpuszczają się w wodzie.