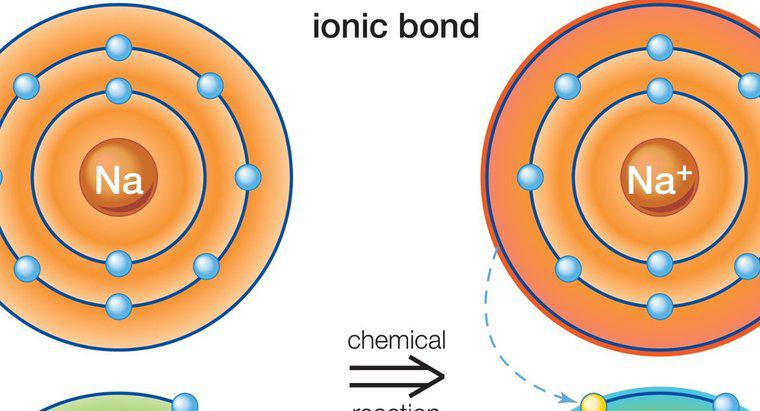
Związki jonowe są elektrycznie obojętne, ponieważ ładunki kationów i anionów, które tworzą związek, znoszą się nawzajem. W przypadku soli, na przykład, sód ma ładunek dodatni i chlorek ma ładunek ujemny. Razem neutralizują związek.
Związki jonowe składają się z dodatnio i ujemnie naładowanych atomów lub cząsteczek. Osoby o ładunku dodatnim nazywane są kationami, natomiast te z ładunkiem ujemnym są nazywane anionami. Obaj są przyciągnięci do siebie z powodu swoich przeciwnych zarzutów. Kationy i aniony mogą przyciągać więcej niż jedną cząsteczkę przeciwnego typu, tworząc dłuższą cząsteczkę utrzymywaną razem przez wiązania jonowe.
Chlorek wapnia jest kolejnym przykładem związku jonowego, z dodatnim wapniem, który eliminuje chlorek ujemny. Bromek żelaza działa tak samo, z dodatnim ładunkiem żelaza, który eliminuje ładunek ujemny z bromku. Ta neutralność elektryczna pomaga utrzymać stabilność związku, ułatwiając pracę i znacznie mniej lotnych niż niestabilne jony.
Większość związków jonowych to ciała stałe o wysokich temperaturach topnienia. Często są one tworzone przez jeden metal i jeden element niemetalowy. Związki wytworzone z dwóch niemetali są często wiązaniami kowalencyjnymi.