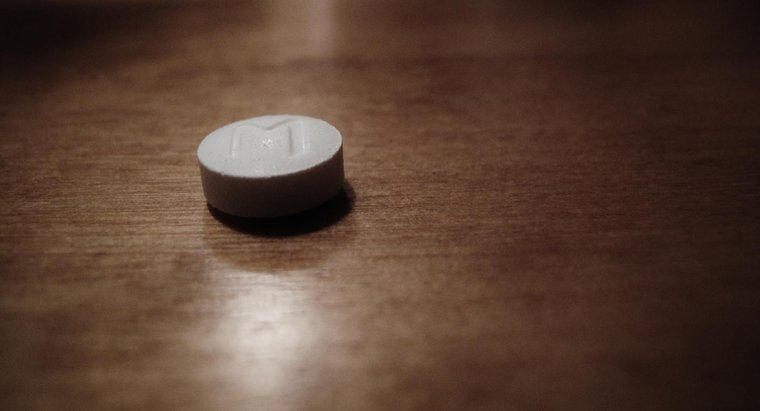
Struktura kropek Lewisa dla H2SO4, czyli kwasu siarkowego, zawiera siarkę w środku otoczoną czterema atomami tlenu. Dwa atomy wodoru łączą się z dwoma atomami tlenu. Elementy są skracane za pomocą symboli chemicznych wymienionych w układzie okresowym pierwiastków, a elektrony dzielone między nimi są oznaczone małymi kropkami. Te elektrony są nazywane elektronami walencyjnymi.
Siarka, lub "S" w strukturze Lewisa, jest otoczona 12 elektronami. Cztery atomy tlenu, wskazane przez "O" na schemacie, są wyrównane na wszystkich czterech bokach S. Dwa z tych atomów tlenu otaczają je sześć elektronów, a pozostałe dwa mają osiem elektronów. Dwa atomy wodoru lub "H" łączą się z dwoma atomami tlenu po przeciwnych stronach diagramu. Wodór ma dwa wspólne elektrony na każdym atomie.
Dwie grupy po cztery elektrony są dzielone pomiędzy siarkę i dwa atomy tlenu, które nie mają przyłączonego do nich wodoru. Pozostałe dwa atomy tlenu mają dwa elektrony z siarką. Na najbardziej zewnętrznych krawędziach atomów tlenu nie ma elektronów walencyjnych. Siarka ma sześć elektronów walencyjnych, tlen ma sześć na każdy atom, a wodór ma po jednym dla każdego atomu.
Elektrony walencyjne łączą się z innymi atomami tworząc molekuły w zewnętrznej powłoce. Są albo podawane innym substancjom, albo dzielone z innymi atomami.