Dwa podstawowe typy ogniw elektrochemicznych to ogniwa galwaniczne i ogniwa elektrolityczne, według UC Davis. Komórki galwaniczne ulegają spontanicznym reakcjom chemicznym i uwalniają energię elektryczną, podczas gdy ogniwa elektrolityczne pobierają energię elektryczną do zasilania nie spontanicznego reakcje chemiczne. Oba typy wymagają anody, katody, roztworów elektrolitów i mostu solnego.
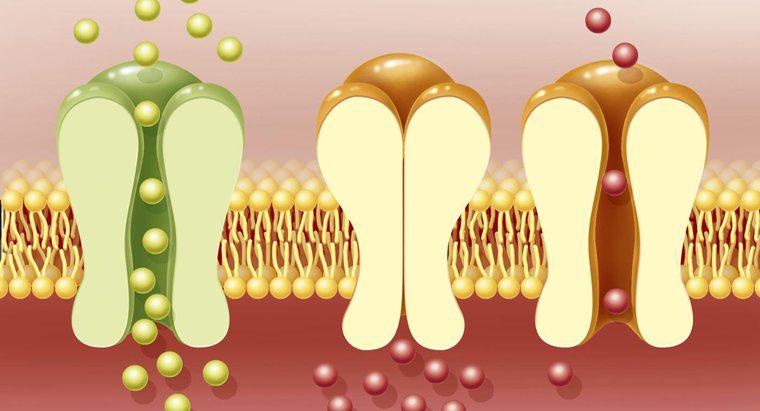
Ogniwa galwaniczne obejmują urządzenia takie jak baterie jednorazowe. Takie urządzenia wytwarzają przepływ elektronów z jednej elektrody do drugiej, generalnie wykonanych z dwóch różnych metali. W ogniwie galwanicznym elektrony przepływają z anody do katody. Podczas tego procesu anoda uwalnia jony metali do otaczającego płynu lub roztworu żelu, elektrolitu. Kiedy elektrony przepływają do katody, są one absorbowane przez jony metali w otaczającym je roztworze, a jony tracą ładunek i stają się standardowymi atomami metalu.
Akumulatory działają jak ogniwa elektrolityczne podczas ładowania i ogniwa galwaniczne podczas zasilania urządzeń, zgodnie z zaleceniami UC Davisa. Komórka elektrolityczna zużywa energię elektryczną, aby wymusić reakcję chemiczną w przeciwnym kierunku, w jakim nastąpiłaby ona spontanicznie. Tak więc reakcja chemiczna zachodząca w akumulatorze jest dokładnym przeciwieństwem reakcji, która ma miejsce, gdy bateria wyzwala energię.