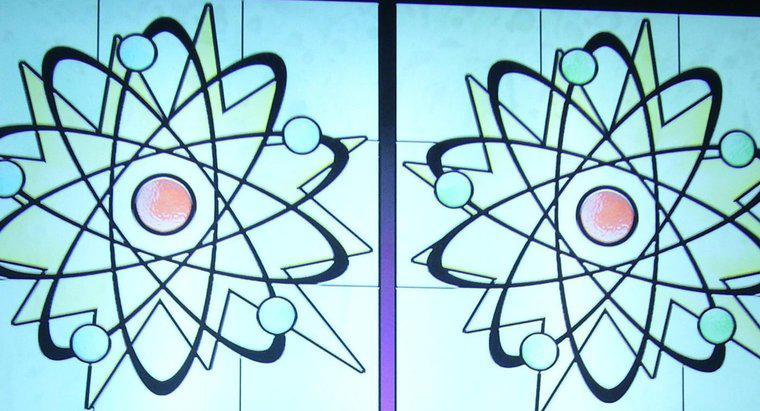
Liczba atomowa atomu to liczba protonów, które znajdują się w jądrze, podczas gdy liczba masowa to liczba połączonych protonów i neutronów. Liczba atomowa określa typ pierwiastka atomowego , podczas gdy liczba neutronów określa izotop pierwiastka. Wiele pierwiastków występuje naturalnie w postaci kilku różnych izotopów.
Wszystkie atomy mają jądro, złożone z grupy protonów i neutronów, a także elektronowej "chmury" otaczającej jądro. Protony są dodatnio naładowanymi cząsteczkami, neutrony są cząstkami, które nie mają ładunku, a elektrony są cząstkami, które mają ładunek ujemny.
W większości przypadków ładunek netto atomu jest neutralny, ponieważ protony i neutrony znajdują się w identycznych ilościach. Kiedy atom zyskuje lub traci elektron, atom staje się naładowanym jonem. Jeśli elektron zostanie utracony, atom staje się dodatnio naładowany; jeśli jednak uzyska elektron, atom staje się naładowany ujemnie.
Jeśli atom traci neutron i staje się izotopem, jego właściwości mogą się różnić od właściwości w naturalnej konfiguracji. Często atomy radioaktywne przechodzą proces rozpadu, który powoduje utratę neutronów przez atom.