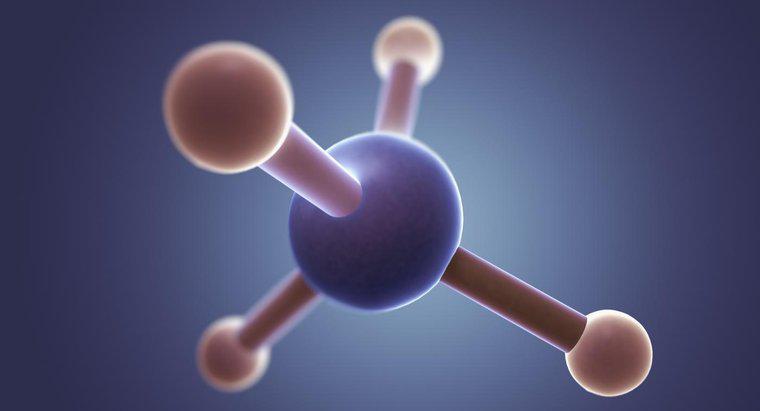
Struktura Lewisa dla CH3Br ma węgiel w centrum z czterema elektronami wokół niego i trzema wodorami i bromem, z których każdy ma pojedynczy elektron z węglem. Brom ma dodatkowe trzy pary elektronów otacza to.
Struktury Lewisa pokazują, jak atomy wiążą się ze sobą tworząc kompletną cząsteczkę i są użyteczne do wykazania wiązania w podstawowych cząsteczkach, takich jak bromometan. W niektórych przypadkach linie są używane do wskazania wiązań, ale kropki są częstsze w przypadku związków podstawowych. Oprócz wiązań elektronów, wykresy te pokazują również niepowiązujące elektrony, tak jak w przypadku bromu w bromometanie. Brom, w tym przypadku, ma trzy pary elektronów, które nie są aktywnie zaangażowane w wiązanie między nim a węglem.
Generalnie, struktury Lewisa wykazują, że większość atomów, z wyjątkiem wodoru, tworzy cząsteczki, aby uzyskać w sumie osiem elektronów w ich zewnętrznych powłokach. Jednak te struktury można również wykorzystać do wskazania ogólnego kształtu cząsteczki. W przypadku bromometanu cztery atomy wokół węgla muszą być rozmieszczone dość równomiernie w przestrzeni 3D, tak aby tworzyły strukturę tetraedryczną. Ponieważ jednak brom tworzy tak długie (a zatem słabsze) wiązanie, wodory mają nieco więcej miejsca niż metanu, co powoduje nieznacznie zniekształcony czworościan.