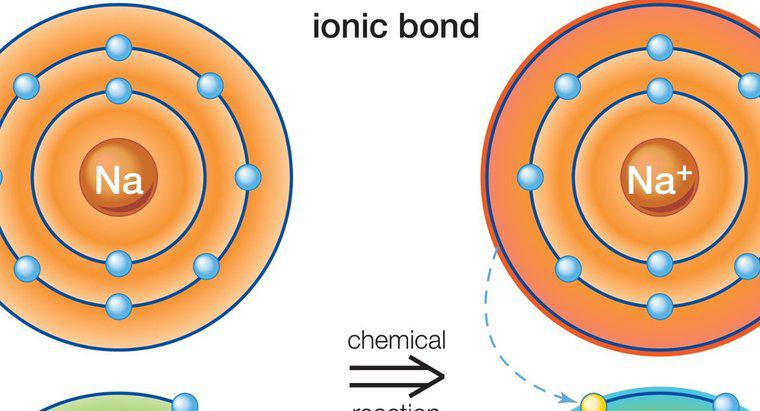
Atomy zaangażowane w wiązanie jonowe są utrzymywane razem przez siłę elektrostatyczną przyciągania między jonem dodatnim i ujemnym. Wiązania jonowe powstają tylko między metalami i niemetalami.
Wiązanie jonowe zachodzi w obecności jonu dodatniego i ujemnego. Jony powstają, gdy obojętne atomy albo tracą, albo zyskują elektron. Wszystkie atomy albo tracą albo zyskują elektrony, aby osiągnąć stabilną konfigurację elektronową. Najbardziej stabilne, szlachetne gazy, wszystkie mają osiem elektronów w ich najbardziej zewnętrznych powłokach, z wyjątkiem helu, który ma tylko dwa elektrony. Kiedy atom ma osiem elektronów w swojej powłoce zewnętrznej, mówi się, że ma stabilną strukturę oktetu.
Metale mają od jednego do trzech elektronów w ich zewnętrznych powłokach, co uniemożliwia im tworzenie stabilnej struktury oktetu. Łatwiej jest tracić elektrony, aby odsłonić znajdującą się pod spodem powłokę z ośmioma elektronami, zamiast zdobywać elektrony w celu uzupełnienia struktury oktetu. Dlatego metale tworzą jony dodatnie. Jednakże niemetale mają tendencję do pozyskiwania jednego lub więcej elektronów w celu uzupełnienia oktetu w ich najbardziej zewnętrznej powłoce, a zatem mają skłonność do tworzenia jonów ujemnych.
Metale mogą przekazywać swoje elektrony do niemetali. Ponieważ ładunki na jonach są niepodobne (dodatnio naładowane jony), dodatnio naładowany atom metalu jest utrzymywany w ujemnie naładowanym niemetalowym atomie o silnej elektrostatycznej sile przyciągania.