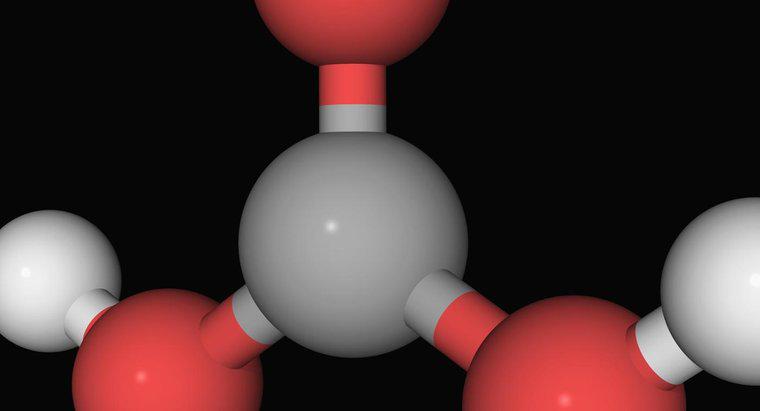
Amoniak, gazowy związek jednego atomu azotu związanego z trzema atomami wodoru, nie jest silną zasadą. Jest słabszą zasadą, która na ogół musi reagować z wodą zanim zareaguje z kwasem. Zanim neutralizuje kwasy w roztworze, reaguje z wodą, tworząc jony amonowe i wodorotlenowe. Amon jest dodatnim jonem jednego azotu i czterech atomów wodoru i jest słabym kwasem.
Wszystkie zasady działają poprzez przyjmowanie jonów wodorowych, które są tylko nagimi protonami. Neutralizuje to kwasy, ponieważ kwasy działają poprzez uwalnianie jonów wodorowych w celu reakcji z innymi materiałami. Zasady reagują z tymi jonami silniej niż inne materiały, dzięki czemu mogą chronić te inne materiały przed kwasami. Jednak same zasady mogą powodować korozję.
Najsilniejsze zasady, takie jak wodorotlenek sodu, działają poprzez dysocjację jonów wodorotlenowych w roztworze. Jony wodorotlenowe reagują bardzo silnie z jonami wodoru tworząc wodę. Pozostałe składniki kwasów i zasad często kojarzą się jako sole. Jednak amoniak nie zawiera jonów wodorotlenowych. Najpierw musi reagować z wodą, aby je wytworzyć. Nie tylko dodaje to kroku przed neutralizacją kwasów, częściowo przeciwdziała temu tworzenie amonu, słabszego kwasu.